
近日,百奥知宣布将正式推出全新的临床研究一体化平台Bioknow eClinical,帮助中国新药研发企业及人员更高效、更安全、更方便地开展临床研究。
随着全球生物医药产业的投资热点逐步转向中国,外部环境和内部经济形势的变化促使国内药企不断加大对创新药研发的投入,同时,2015年以来,国家及NMPA等多个政府机构从各个层面出台政策引导国内企业规范和注重研发,鼓励新药创新,更对临床研究、数据管理、安全警戒、注册申报等新药研发各个环节提出了明确而严格的要求,行业各方在数据/过程/文档信息化方面的机遇与挑战并存。
通过对我国新药研发的观察不难发现,在临床研究信息化过程中仍存在很多问题:

我国当前临床研究管理现状中也存在数据或文档格式多样化、数据准确性不确定、数据或文档分散不便统一管理、人员变动频繁可能导致文件丢失等现象,导致企业需要花费大量的时间、人力、物力来处理数据/文档/过程三方规范性、安全性、协调难的问题。
百奥知精耕药物研发信息化12年,凭着对国内外法规和行业特点的深刻理解,将本公司覆盖新药研发全生命周期的十余款信息化产品如Bioknow EDC(临床试验数据电子采集系统)、Bioknow RTSM(随机化与试验药物管理系统)、Bioknow MedCoding(医学编码系统)、Bioknow CDTMS(临床数据全流程管理系统)、Bioknow PV(药物安全警戒管理系统)、Bioknow eTMF(临床试验全文档管理系统)、Bioknow CTMS(临床试验项目管理系统)、Bioknow PDM(临床试验读片与标本运送管理系统)、Bioknow RIMS(影像阅片系统)等集成至一个平台——Bioknow eClinical(百奥知临床研究一体化平台),使各信息化产品间互联互通,更通过人工智能技术赋能各产品,达到标准统一、数据互通、流程协作、文档规范,帮助各方加快临床研究进程和新药上市的步伐。
Bioknow eClinical率先实现“一个入口、一个账号、一次录入”,真正做到信息统一维护、账户统一管理,集成消息入口、项目全局掌控。
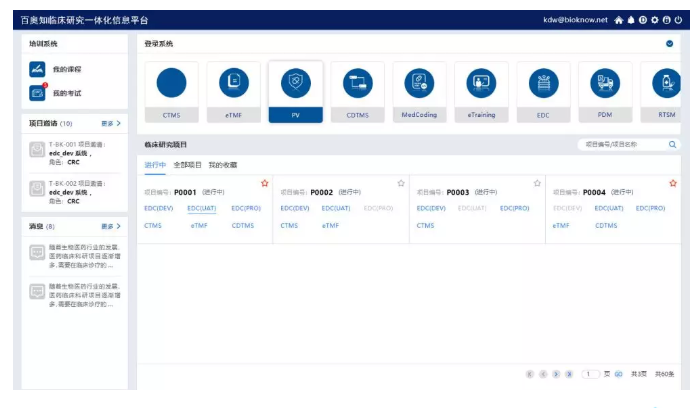
集成操作、方便使用
用户在使用Bioknow eClinical时,各系统自由切换、各项目系统方便进入。
信息与资源安全可控
通过角色授权控制,统一管理新药研发的参与方、项目和过程管理全部信息,安全可控。
研究成本显著降低
一体化平台与标准体系下,做到多项目并行,整体降低项目综合成本的40%。
临床研究时间大幅缩短
通过流程化协作、实现人员、项目和过程无缝对接,缩短30%的研究管理时间,减少时间耗损。
Bioknow eClinical作为一个开放性的新药研发协作平台,已经在多家药厂和CRO公司实施,现也正积极接受广大用户的体验,欢迎致电致函预约百奥知专业人员为您做专门演示。
预约电话:4008-313-59
预约邮箱:market@bioknow.net