
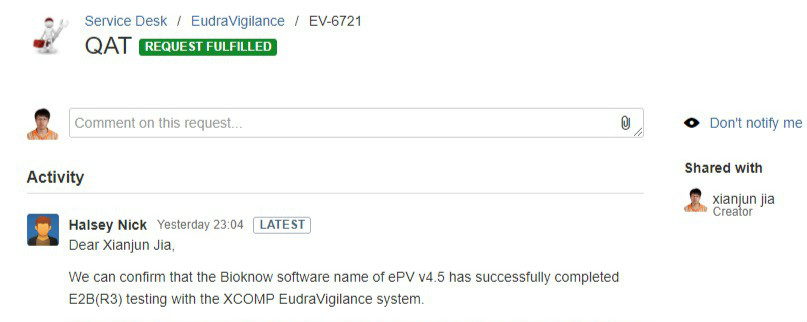
2019年8月5日,百奥知PV系统成功完成欧洲药物管理局(European Medicines Agency, EMA)EudraVigilance药物警戒数据库的E2B(R3) Gateway对接测试,助力中国上市许可持有人(MAH)产品走向国际,更高效地开展药物警戒工作。
随着中国医药事务国际化步伐加速,中国制药企业海外业务的拓展需求不断上涨。百奥知PV系统不仅为MAH产品国内上市提供必要的药物警戒系统技术支持,更是凭借多年的技术积累和科研人员的集中攻关,成功对接EudraVigilance,满足境外法规的要求,为国内产品走向国际化,提供合规、简单、高效的信息化解决方案。 同时,百奥知PV跟国内众多CRO形成良好的合作关系,为医药企业提供全方位的药物警戒服务,助力中国制药企业走向国际,中国新药走向全球。
测试Case场景涵盖:
① 欧盟区域(European Economic Association,EEA)的SUSAR病例
② 观察性研究(Observational Study)病例
③ Parent-Child病例
④ 非欧盟区域SUSAR病例
⑤ 文献病例
⑥ 带附件病例
⑦ 首次报告/随访报告
⑧ 报告的作废(Nullification)
⑨ UCUM相关病例
⑩ 实验室检查病例